

|
|
|||||||
| المواد العلمية و التقنية كل ما يخص المواد العلمية و التقنية: الرياضيات - العلوم الطبيعة والحياة - العلوم الفيزيائية - الهندسة المدنية - هندسة الطرائق - الهندسة الميكانيكية - الهندسة الكهربائية - إعلام آلي. |
في حال وجود أي مواضيع أو ردود
مُخالفة من قبل الأعضاء، يُرجى الإبلاغ عنها فورًا باستخدام أيقونة
![]() ( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
| آخر المواضيع |
|
♥ ~ سلام .. ممكن احد يدخل يفهمني كيمياء ♥ ~
 |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
|
رقم المشاركة : 16 | ||||
|
ما الشيء الدي لم تفهميه بالضبط و سوف نناقشه
|
||||

|
|
|
رقم المشاركة : 17 | |||
|
ارجوا ان تضعي ما لم تفهمي كي نستطيع المساعدة يا اختاه |
|||

|
|
|
رقم المشاركة : 18 | |||
|
اسفة على التاخير ممكن مراجعة من الجدول الدوري
الى غاية تمثيل كرام |
|||

|
|
|
رقم المشاركة : 19 | |||
|
واش مفهمتيش في الجدول الدوري ؟؟ |
|||

|
|
|
رقم المشاركة : 20 | |||
|
بارك الله فيكم .. |
|||

|
|
|
رقم المشاركة : 21 | |||
|
طيب كيما تبغي اختي |
|||

|
|
|
رقم المشاركة : 22 | |||
|
لا يوجد اشكال .. |
|||

|
|
|
رقم المشاركة : 23 | |||
|
رموز العناصر المتفق عليها دولياً اسم العنصر HeBrNFeClCuPAgالرمز اسم العنصر الرمز 2. إذا علمت أن رمز عنصر الكربون C فاكتب بخط واضح وبطريقة صحيحة رمزاً محتملاً لكل عنصر من العناصر التالية : (ليس من الضروري أن يكون الرمز المعتمد دولياً) . اسم العنصر بالعربية كاليفورنيومCaliforniumالكروم Chromiumالكادميوم Cadmiumالسيريوم Ceriumالسيزيوم Cesiumالكوريوم Curiumالاسم بالإنجليزية الرمز المحتمل 3. ما العنصر وكم عدد الذرات في كل حالة مما يلي : S8 Ne (F2)7 5Si 4O3 أ) ذرتان من الألمنيوم . ب) إثنتا عشرة ذرة من الخارصين . ج) ماية وأربعون ذرة من الكربون . |
|||

|
|
|
رقم المشاركة : 24 | |||
|
إحابات الاختبار القبلي / البعدي اسم العنصر هيليوم Heبروم Brنيتروجين Nحديد Feكلور Clنحاس Cuفسفور Pفضة Agالرمز اسم العنصر الرمز اسم العنصر بالعربية كاليفورنيومCaliforniumالاسم بالإنجليزية الرمز المحتمل Co - Cr - Ci - Cf - Cn - Cm الكروم ChromiumCi - Cm - Cr - Ch الكادميوم CadmiumCd - Cm - Ci السيريوم CeriumCi - Cm - Cr - Ce السيزيوم CesiumCi - Cm - Cs - Ce الكوريوم CuriumCi - Cm - Cr 1. عدم استخدام رموز العناصر المطلوب حفظها مثل Ca للكالسيوم و Cu للنحاس ، و Cl للكلور . 2. يجب عدم اختيار الرمز نفسه لعنصرين أو أكثر وإذا حدث ذلك تعتبر كل الإجابات خاطئة ولا يحسب لها أي علامة . 3. S8 Ne (F2)7 5Si 4O3 ثماني ذرات من الكبريت ذرة نيون أربعة عشرة ذرة من الفلور خمس ذرات سيليكون إثنتا عشرة ذرة من الأكسجين 4. أ) ذرتان من الألمنيوم .
(Al)2 2Al Al2 ب) إثنتا عشرة ذرة من الخارصين . (Zn)12 12Zn Zn12 ج) ماية وأربعون ذرة من الكربون . (C)140 140C C140 |
|||

|
|
|
رقم المشاركة : 25 | |||
|
أولاً : العناصر والأيونات ، استعن بالجدول الدوري   كم عدد الكترونات التكافؤ لذرة الصوديوم ؟ كم عدد الكترونات التكافؤ لذرة الصوديوم ؟1 (واحد)  كيف يمثل لويس ذرة الصوديوم ؟ كيف يمثل لويس ذرة الصوديوم ؟ أنه يمثلها بالرمز Na . الرمز Na هو رمز الصوديوم المتفق عليه دولياً وهو هنا (بحسب لويس) يمثلنواة ذرة الصوديوم والكتروناته الداخلية العشرة ، أما النقطة بقرب الرمز فهي رمز الكترون التكافؤ الخاص به . عدد الكترونات التكافؤ لذرة الصوديوم هو ( 1 ) وهو يدل على المجموعة الأولى التي ينتمي إليها الصوديوم في الجدول الدوري . نعلم أن الصوديوم يفقد هذا الالكترون عند دخوله في تفاعل كيميائي مع عنصر آخر ، وعند ذلك تنتج ذرة صوديوم مشحونة بشحنة موجبة واحدة لأن عدد البروتونات ( + 11 ) ، بقي كما هو بينما أصبح عدد الالكترونات ( 10 ) . نسمي ذرة الصوديوم المشحونة باسم أيون الصوديوم SodiumIon ويصبح رمزها حسب لويس[ Na ]+دون نقط أي دون الكترونات لأنها فقدت الكترون التكافؤ الوحيد الخاص بها .  تدريب (1) : طبِّق ما قمنا به من عمل في مثال الصوديوم أعلاه على عنصر البوتاسيوم . تدريب (1) : طبِّق ما قمنا به من عمل في مثال الصوديوم أعلاه على عنصر البوتاسيوم . رمزالبوتاسيوم رمزالبوتاسيومK  ينتمي للمجموعة الأولى مثل الصوديوم ويقع تحته في الجدول الدوري ينتمي للمجموعة الأولى مثل الصوديوم ويقع تحته في الجدول الدوري العدد الذري للبوتاسيوم العدد الذري للبوتاسيوم19  التوزيع الإلكتروني للبوتاسيوم التوزيع الإلكتروني للبوتاسيوم   تمثيل لويس لذرة البوتاسيوم تمثيل لويس لذرة البوتاسيومK .  تمثيل لويس لأيون البوتاسيوم تمثيل لويس لأيون البوتاسيوم+ [ K ]
|
|||

|
|
|
رقم المشاركة : 26 | |||
|
إنه يمثلها بالرمز  كيف يمثل لويس ذرة الكلور ؟ كيف يمثل لويس ذرة الكلور ؟ومعنى هذا التمثيل هو أن الرمز المتفق عليه دولياًClيمثل نواة ذرة الكلور والكتروناته الداخلية العشرة . أما النقاط السبع حول الرمز فهي تمثل الكترونات التكافؤ لذرة الكلور وهي تدل على أن الكلور من عناصر المجموعة السابعة في الجدول الدوري . نعلم أن ذرة الكلور الواحدة تكسب الكتروناً عند دخولها في تفاعل كيميائي مع عنصر فلزي (مثل الصوديوم) وعند ذلك يزيد عدد الالكترونات الخارجية فيصبح ثمانية وتصبح ذرة الكلور مشحونة بشحنة سالبة ( لأن عدد البروتونات فيها 17 بينما أصبح عدد الإلكترونات 18) ، نسمي ذرة الكلور المشحونة باسم أيون الكلوريد ونمثله حسب لويس كما يلي :  وقد مثلنا الإلكترون الجديد بلون آخر لمجرد التوضيح والتذكير بأنه أتى من ذرة أخرى |
|||

|
|
|
رقم المشاركة : 27 | |||
|
مثال (3) :الأكسجين |
|||

|
|
|
رقم المشاركة : 28 | |||
|
نستخدم طريقة لويس في التعبير عن الذرات ونوسعها لتشمل الأيونات والمركبات الكيميائية سواء أكانت الرابطة فيها من النوع الأيوني أم المشترك ، كما نستخدمها للتعبير عن مجموعات العناصر في الجدول الدوري بطريقة بسيطة نوضحها فيما يلي . المجموعةتمثيل لويس للعنصرتمثيل لويس للأيونمثال للعنصرالأولى لاحظ أن قاعدة الثمانية التي وضعها لويس والتي نصها : (حتى تستقر الذرات يجب أن يحاط مدارها الأخير بثمانية الكترونات) . هي نتيجة لما كان علماء الكيمياء قد درسوه ولاحظوه على عناصر الغازات النبيلة (المجموعة الثامنة) من قلة النشاط الكيميائي ، حيث لا تبدي رغبة في التفاعل مع غيرها من العناصر وتكوين المركبات ، وهذا ما جعل لويس يعتبرها نموذجاً ومثالاً يحتذى للعناصر الأخرى النشطة والفعالة ، التي يكون في ذراتها عدداً من الإلكترونات غير المزدوجة ، وعندما تتحد مع بعضها وتكوّن مركبات تربط بينها روابط مشتركة أو أيونية تزدوج الكتروناتها ويصبح التوزيع الإلكتروني للواحد منها مشابهاً للتوزيع الإلكتروني للغاز النبيل الأقرب إليه ، فأيون الصوديوم والمغنيسيوم يصبح توزيعها الإلكتروني مشابهاً للنيون . وأيون الكلوريد يصبح توزيعه مشابهاً للأرجون القريب منه .  X+ X+ الثانية الثانية X2+ X2+ الثالثة الثالثة X3+ X3+ الرابعة الرابعة عناصرها تكون روابط مشتركة ونادراً ما تكون روابط أيونية عناصرها تكون روابط مشتركة ونادراً ما تكون روابط أيونية الخامسة الخامسة كما هو الحال مع المجموعة الرابعة كما هو الحال مع المجموعة الرابعة السادسة السادسة   السابعة السابعة   الثامنة الثامنة مجموعة الغازات النبيلة ، الذرات مستقرة لأن عدد الكترونات التكافؤ ثمانية  : |
|||

|
|
|
رقم المشاركة : 29 | |||
|
ثالثاً : أمثلة على تمثيل المركبات ذات الرابطة المشتركة بطريقة لويس :  صيغة لويس إما صيغة لويس إما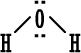 أو أوعدد الكترونات تكافؤ الأكسجين ( 6 ) . عدد الكترونات تكافؤ الهيدروجين ( 1 ) . (مجموع عدد الكترونات التكافؤ 8 ) . 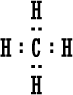 نمثله إما نمثله إما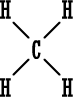 وإما وإماعدد الكترونات تكافؤ الكربون ( 4 ) . عدد الكترونات تكافؤ الهيدروجين ( 1 ) ويوجد منه (4 ) ذرات إذن عدد الإلكترونات ( 4 ) . مجموع عدد الكترونات تكافؤ ( 8 ) .  صيغة لويس صيغة لويس  أو أوعدد الكترونات تكافؤ الكلور ( 7 ) . عدد الكترونات تكافؤ الهيدروجين ( 1 ) . مجموع عدد الكترونات التكافؤ ( 8 ) .   عدد الكترونات تكافؤ الأكسجين ( 6 ) ، ويوجد منه ذرتان ، مجموع الكتروناتها ( 12 ) . عدد الكترونات تكافؤ الكربون ( 4 ) . مجموع عدد الكترونات التكافؤ ( 16 ) . 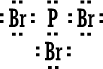 الكترونات تكافؤ الفوسفور ( 5 ) . الكترونات تكافؤ البروم ( 7 ) ويوجد منه ثلاث ذرات مجموع الكتروناتها ( 21 ) . مجموع الكترونات التكافؤ ( 26 ) . |
|||

|
|
|
رقم المشاركة : 30 | |||
|
رابعاً : تمثيل المركبات الأيونية بطريقة لويس وبالطريقة المختصرة : أيون الصوديوم وباختصار NaCl (المركب متعادل ، لماذا ؟)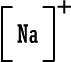 أيون الكلوريد أيون الكلوريد كلوريد الصوديوم كلوريد الصوديوم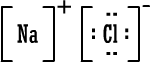 2) أوكسيد المغنيسيوم أيون المغنيسيوم وباختصار MgO ( المركب متعادل ، لماذا ؟ ) 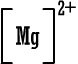 أيون الأوكسيد أيون الأوكسيد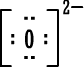 أكسيد المغنيسيوم أكسيد المغنيسيوم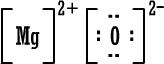 3) بروميد الألومنيوم أيون الألومنيوم 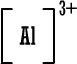 أيون البروميد أيون البروميد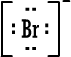 بروميد الألومنيوم بروميد الألومنيوم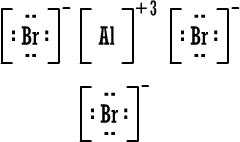 أما صيغة بروميد الألومنيوم باختصار فهي AlBr3 ( المركب متعادل ، لماذا ؟ ) |
|||

|
 |
| الكلمات الدلالية (Tags) |
| ممكن, جيجل, يفهمني, سلام, كيمياء |
|
|
المشاركات المنشورة تعبر عن وجهة نظر صاحبها فقط، ولا تُعبّر بأي شكل من الأشكال عن وجهة نظر إدارة المنتدى
المنتدى غير مسؤول عن أي إتفاق تجاري بين الأعضاء... فعلى الجميع تحمّل المسؤولية
Powered by vBulletin .Copyright آ© 2018 vBulletin Solutions, Inc