

|
|
|||||||
| المواد العلمية و التقنية كل ما يخص المواد العلمية و التقنية : الرياضيات - العلوم الطبيعة والحياة - العلوم الفيزيائية - الهندسة المدنية - هندسة الطرائق - الهندسة الميكانيكية - الهندسة الكهربائية - التسيير المحاسبي و المالي - تسيير و اقتصاد |
في حال وجود أي مواضيع أو ردود
مُخالفة من قبل الأعضاء، يُرجى الإبلاغ عنها فورًا باستخدام أيقونة
![]() ( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
| آخر المواضيع |
|
█ ► ↩ ملُِخـص آلُِوُحٍدِة آلُِثآنية ↪ ↞↞↞ العٍلُِآقٌة بَن آلُِبَنية وُآلُِوُظًيفُة ◄▌▒
 |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
|
رقم المشاركة : 1 | ||||
|
سلاااامو
ملاحظة قبل مانبداو : جيبوا معاكم الكتاب ولي معندوش يشري ولي معندوش مسكين زوالي ( gليل )  ها تفضل رابط تحميل الكتاب : https://eddirasa.com/wp-*******/uplo...ce_sci_PDF.zip كلمة سر الملف : eddirasa.com بسم الله نبداو على بركة الله تمثيل البنية الفراغية للبروتين تمثيل البنية الفراغية للجزيئات البسيطة: يمكن تمثيلها بعدة نماذج أهمها: * نموذج الكرة والعود (Bâtonnets et Boules) : يهدف الى اظهار الذرات والروابط الموجودة فيما بينها. * نموذج الكرة او المكدس (Sphères) : إظهار حجم الجزيئة وتظهر الذرات فقط. * نموذج العود ( Bâtonnets ) : إظهار الروابط الكيميائية في الجزيئة. * نموذج الخيط الحديدي ( fer de Fil ) : يبين الروابط وتكون على شكل خيط رقيق. نماذج مختلفة لتمثيل بنية حمض أميني: الوثيقة ( 1 )ص40. تمثيل البنية الفراغية للجزيئات الكبيرة : يمكن تمثيلها بنفس النماذج السابقة باإلضافة الى نماذج أخرى تسمح بتوضيح جوانب أخرى من البنية الفراغية وهي: * الشريطي(Rubans ) و الشريطي السميك ( Caricatures) : يسمح بتوضيح البنيات الثانوية للجزيئة حيث تظهر البنيات الحلزونية خ± على شكل شريط حلزوني وردي اللون، بينما البنيات الوريقية خ² تظهر بشكل وريقات مطوية بلون أصفر، كما يسمح بإظهار مناطق االنعطاف في شكل خيط سميك أبيض أو أزرق. - نماذج مختلفة لتمثيل بنية بروتين: الوثيقة (2 ) ص41. مميزات برنامج Rastop في دراسة البروتينات : - عرض البنية الفراغية ثالثية األبعاد للجزيئات بنماذج مختلفة. - دراسة البنية الثانوية بتحديد عددها ونوعها في البروتين. - تحديد عدد السالسل الببتيدية المكونة للبروتين. - تحديد عدد ونوع وتسلسل األحماض األمينية في البروتين. - تحديد الجزء البروتيني والجزء غير البروتيني في الجزيئات. - التعرف على الموقع الفعال للبروتين. - التعرف على مختلف الروابط التي تساهم في ثبات البنية ( روابط هيدروجينية، جسور كبريتية..... ) مستويات البنية الفراغية لبروتينات : - تتميز البنية الفراغية البروتينات بالتعقيد وتختلف درجته بين البروتينات ويمكن وصف 4 مستويات بنيوية متدرجة التعقيد هي: البنية الأولية : - ارتباط أحماض أمينية بروابط ببتيدية لتكوين سلسلة ببتيدية بدايتها NH2 ونهايتها COOH. مميزات البنية األولية : الوثيقة (1 ) ص42 البنية الثانوية : - هي التفاف البنية األولية في مناطق محددة في شكل بنيات حلزونية خ± أو بنيات وريقية خ² وهذا بتشكل روابط هيدروجينية بين NH وCO التابعة للروابط الببتيدية. - مميزات البنية الثانوية: الوثيقة (2 )ص42. البنية الثالثية: - هي انطواء البنية الثانوية على مستوى مناطق االنعطاف لتأخذ بنية فراغية محددة تحافظ على ثباتها بروابط مختلفة (كبريتية،شاردية، هيدروجينية، تجاذب الجذور الكارهة للماء). - مميزات البنية الثالثية: الوثيقة ( 3 )ص43 البنية الرابعية : -هي ارتباط سلسلتين ببتيديتين أوأكثر بروابط ضعيفة تحافظ على استقرارها لكل منها بنية ثالثية وتسمى كل واحدة "تحت الوحدة" - مميزات البنية الرابعية: الوثيقة (4 ) ص44 العلاقة بين بنية ووظيفة البروتين : - إن اختالف البنية الفراغية للبروتينات يعود الى اختالف عدد ونوع وترتيب األحماض األمينية الداخلة في تركيبها. تعريف الأحماض الأمينية : - هي جزيئات بسيطة تمثل الوحدة البنائية األساسية للبروتينات، وهي مركبات عضوية مقسمة الى جزأين: * جزء ثابت: يتكون من وظيفة أمينية (NH2 ) ووظيف ةكربوكسيلية (COOH ) متصلتين بذرة كربون مركزية (Cخ± ) التي تتصل أيضا مع (H ) وهو موجود عند جميع الأحماض الأمينية * جزء متغير: يتمثل في سلسلة جانبية أو جذر ألكيلي يرمز له (R) ويختلف تركيبه من حمض أميني الأخر تصنيف الأحماض الأمينية : يمكن تصنيفها حسب الجزء المتغير ( الجذر R )إلى 3 أصناف: * أحماض أمينية حامضية: يحتوي الجذر على مجموعة حمضية (COOH )عددها 2 هي: غلوتاميك (Glu ) وأسبارتيك (Asp) * أحماض أمينية قاعدية : يحتوي الجذر على مجموعة أمينية(NH2 )عددها 3 وهي: ليزين(Lys ) أرجينين (Arg) هيستدين (His) * أحماض أمينية متعادلة: تمتاز بعدم وجود مجموعة حمضية أو قاعدية في الجذر R وعددها 15 يمكن تقسيمها حسب نوع الوظائف الموجودة في جذورها الى: كحولية، عطرية، كبريتية، أليفاتية، أميدية، حلقية. تشكل الرابطة الببتيدية بين الأحماض الأمينية : هي رابطة تكافؤية قوية تتشكل بين المجموعة الكربوكسيلية للحمض األميني األول والمجموعة األمينية للحمض األميني الموالي مع انطالق جزيء من الماء. سلوك الأحماض الأمينية في الوسط : - يتغير سلوك الحمض األميني بتغير درجة pH الوسط، وهجرته في المجال الكهربائي تعتمد على نوع الشحنة التي يكتسبها. - تسلك األحماض األمينية سلوك األحماض( تفقد بروتونات) في الوسط القاعدي وتسلك سلوك القواعد ( تكتسب بروتونات) في الوسط الحامضي لذلك تسمى بالمركبات الأمفوتيرية (الحمقلية) القاعدة التي تسمح بتحديد شحنة الحمض األميني: -تعريف نقطة التعادل الكهربائي (PHi) هي قيمة يكون عندها الحمض األميني متعادل كهربائيا، عدد الشحنات الموجبة والسالبة متساوي أي شحنة معدومة (0) - PH=PHi شحنة الحمض األميني معدومة (0) : - ال يهاجر الى أي قطب ( يبقى في المنتصف ) ويدل على تساوي الشحنات (+) و(-) أي تأين الوظيفة األمينية ( +NH3 ) والحمضية ( - COO ) ومنه يسلك سلوك حمض وقاعدة في نفس الوقت - PH>PHi شحنة الحمض األميني موجبة (+) : - يهاجر الى القطب (-) ويدل على اكتسابه بروتون (+H ) من الوسط وتأين الوظيفة الأمينية ومنه يسلك سلوك قاعدة في وسط حامضي - PH<PHi شحنة الحمض األميني سالبة (-) : - يهاجر الى القطب (+) ويدل على فقدانه بروتون (+H ) من الوسط وتأين الوظيفة الحمضية ومنه يسلك سلوك حمض في وسط قاعدي - القاعدة التي تحدد قيمة PHi التقريبية لألحماض األمينية : * الأحماض الأمينية المتعادلة : لها PHi قريب من المعتدل. * الأحماض الأمينية الحامضية : لها PHi أقل من المعتدل. * الأحماض الأمينية القاعدية : لها PHi أكبر من المعتدل. دوك نحطلكم الصيغة العامة للأحماض الأمينية و كيفية تشكيل الرابطة البيبتيدية على شكل صور باه تفهموا بياا يتبع ....
|
||||

|
|
|
رقم المشاركة : 2 | |||
|
هههههه اخيرا و ليس اخرا |
|||

|
|
|
رقم المشاركة : 3 | |||
|
مشكور اخي على هذا الجهد بارك الله فيك جعلها في ميزان حسناتك |
|||

|
|
|
رقم المشاركة : 4 | |||
|
بارك اللهفيك اخ ميدو بوركت حقا |
|||

|
|
|
رقم المشاركة : 5 | |||
|
شكرا ميدو وفرت على عناءا كتابة الوحدة الثانية |
|||

|
|
|
رقم المشاركة : 6 | |||
|
بااارك الله فيك ميدووش ساحاول فهم قدر مستطااع |
|||

|
|
|
رقم المشاركة : 7 | ||||
|
اقتباس:
ياسيدي غير نسينا الياء برك
بن عمييييييي ههه == وفيك البركة بالتوفيق ^^ |
||||

|
|
|
رقم المشاركة : 8 | ||||
|
اقتباس:
وفيـــــك البركة بالتوفيــق ^^ |
||||

|
|
|
رقم المشاركة : 9 | |||
|
وفيـــك البركة
شكراا ^^ |
|||

|
|
|
رقم المشاركة : 10 | ||||
|
اقتباس:
العفوو أختي الكريمة
== أوكي مكااش مشكل ^^ |
||||

|
|
|
رقم المشاركة : 11 | ||||
|
اقتباس:
وفيـــك البركة
نشاله بالتوفيق ^^ |
||||

|
|
|
رقم المشاركة : 12 | |||
|
الصيغة العامة للأحماض الأمينية
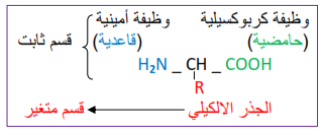 كيفية تشكيل الرابطة البيبتيدية 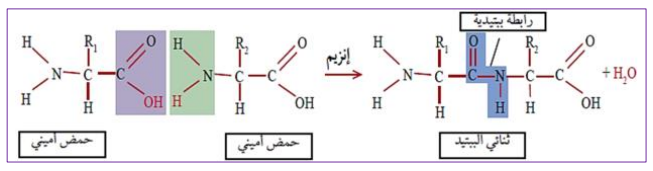 بالتوفيـــق ^^ |
|||

|
|
|
رقم المشاركة : 13 | |||
|
ميدو |
|||

|
|
|
رقم المشاركة : 14 | |||
|
بارك الله فيك على الافادة |
|||

|
|
|
رقم المشاركة : 15 | |||
|
شكرا بارك الله فيك فقد تعلمت كثيرا من ملخصك |
|||

|
 |
| أدوات الموضوع | |
| انواع عرض الموضوع | |
|
|
المشاركات المنشورة تعبر عن وجهة نظر صاحبها فقط، ولا تُعبّر بأي شكل من الأشكال عن وجهة نظر إدارة المنتدى
المنتدى غير مسؤول عن أي إتفاق تجاري بين الأعضاء... فعلى الجميع تحمّل المسؤولية
Powered by vBulletin .Copyright آ© 2018 vBulletin Solutions, Inc